微生態制劑被攝入動物體腸道后,在復雜的微生態環境中與體內正常菌群匯合,顯現出棲生、偏生、競爭或吞噬等復雜的關系,可以改變生物體內的微生物群落,促進宿主動物的健康(章劍,2000)。關于水產動物益生菌與其免疫力的關系已有一些報道(桂遠明等,1994;黃永春和王盛倫,1997;Sirirat et al.,2000)。本試驗通過利用從斑點叉尾鮰消化道中分離的BHI344菌株(根據鑒定結果屬于Bacillus sp.)定量添加在飼料中投喂后,觀察了對斑點叉尾鮰免疫機能的影響,探討BHI344菌株的作用機理,為BHI344菌株的研究開發提供實驗依據。
1 材料與方法
1.1試驗魚分組及飼養。
試驗地點選擇在武漢市野芷湖漁場。網箱飼養的用斑點叉尾鮰購于。選擇體格健壯、平均體重100g的斑點叉尾鮰,分養于水泥池中。水泥池的規格為2m×2m×1m。本試驗利用從斑點叉尾鮰消化道中分離的BHI344菌株濃度的不同分為4組,B0組為不含BHI344菌株的基礎飼料(購于通威飼料公司,為168#飼料),B1組、B3組、B5組為分別含有1.0×1011cfu/kg飼料、3.0×1011cfu/kg飼料、5.0×1011cfu/kg飼料的BHI344菌株的飼料。每組70尾。
試驗期間按試驗要求分別投喂不同飼料,其中B1組、B3組、B5組投喂對應含BHI344菌株飼料28d后,改投與B0組相同的不含BHI344菌株的飼料。試驗魚進池后先暫養、馴養兩周后,再開始正式試驗。在整個試驗期間,保持微流水。溶氧5~6 mg/L,pH 6.8左右。每日喂食兩次(8:30-9:00,16:00-16:30),每日投餌量為魚體重的3.0%~5.0%。
1.2 試驗飼料及加工。
將購買的商品飼料(168#飼料)粉碎后,按需要量加入BHI344菌株;B0組則加入相等量的生理鹽水。將其充分拌勻,用小型制粒機加工成直徑為2.5mm的顆粒,于45℃下烘干,保存備用。
1.3 吞噬原的制備。
將金黃色葡萄球菌接種在FWA培養基上,28℃培養36h,集菌,并用無菌生理鹽水離心洗滌2次,制成菌懸液備用。然后在S.aureus懸液中加入終濃度為0.5%的福爾馬林,28℃滅活24 h。將福爾馬林滅活的S.aureus菌體,作為本試驗中的吞噬原。經過平皿法證實此菌已被徹底滅活后,置4℃冰箱中保存備用。
1.4試樣收集。
分別于投喂BHI344菌株前和投喂后的第4d、7d、14d、21d、28d及停止投喂BHI344菌株后的第7d、14d的上午進行試樣收集。采用心臟取血和斷尾取血,每組取6尾魚。斷尾取血后,將每尾魚的血液分成2份:1份置室溫1h,再置冰箱內4h,以2000r/min離心15min分離血清,供檢測溶菌酶活性;另1份以肝素抗凝,供測定白細胞吞噬活性。心臟取血離心分離獲得血液淋巴細胞,供測定淋巴細胞轉化率。
取斑點叉尾鮰前、中、后腸各一段約1cm長,立即放入Bouin氏液中固定,固定半天后,仔細修整,剪為0.1-0.2cm長的片段,經石蠟包埋、切片、HE染色后,用于觀察腸上皮內淋巴細胞。
1.5白細胞吞噬活性測定。
在0.25mL抗凝血中加入0.1mL用滅菌生理鹽水調整為1×108cells/mL的S. aureus懸液,搖勻后置于28℃恒溫水浴鍋中,孵育1 h,每個血樣做血涂片5張,自然晾干,甲醇固定,Giemsa染色2 h,水洗晾干后置油鏡下觀察計數,并按下式計算吞噬百分比(Phagocytic percentage,PP)和吞噬指數(Phagocytic index,PI)。
吞噬百分比(PP)=(100個白細胞中參與吞噬的細胞數/100)×100
吞噬指數(PI)=被吞噬的細菌數/吞噬細菌的細胞數
1.6血清溶菌酶活性測定。
1.61 菌液的制備:以溶壁微球菌(Micrococcus lysoleikticus,Sigma公司產品)凍干粉為底物,用1/15 mol/L,pH 6.4磷酸緩沖液配成一定濃度的懸濁液,用722型分光光度計于640 nm測定并調整其濃度,使透光率達30%-40%(OD640=0.3,菌濃度為4×106cfu/mL)。將此菌液作為測定溶菌酶活性的底物。
1.62溶菌酶活性的測定:取0.1mL血清于小試管中,置28℃水浴鍋中預熱5min,然后加入1.8mL已預熱的菌液,立即計時,至2min時加入2滴5mol/L KOH溶液以終止反應,立即用0.5 cm比色±于640nm波長測其透光率T1%。取同樣血清0.1mL于2滴5mol/L的KOH溶液中搖勻,28℃預熱5min后加入1.8mL已預熱的菌液,在同樣溫度下至2min時同法測定其透光率T0%。T1%£T0%為透光率差值,即溶菌酶所致透光率的變化。再從標準曲線上查血清中溶菌酶活性。
1.63 標準曲線的制備:準確稱取溶菌酶標準品(Amresco產品,20000u/mg),用pH 6.4,1/15 mol/L PBS配成1000μg/mL,臨用時用PBS稀釋成500μg/mL、100μg/mL、50μg/mL、25μg/mL、10μg/mL標準液,用0.1mL各種濃度的溶菌酶標準液代替血清樣品,操作方法與以上測血清的相同。根據測得的不同濃度標準液透光率的變化值得到標準曲線:y=20×(8.963x£22.362),可按此式計算血清樣品溶菌酶活性。其中y表示溶菌酶活性(單位:u/mL),x表示反應前后濃度透光率差值。
1.7 淋巴細胞轉化率測定。
斑點叉尾鮰血液中淋巴細胞的分離參照楠田等(1996)的方法進行。血液淋巴細胞轉化率的測定參照陳昌福(1998)和唐玫(2001)的方法進行。用經肝素處理的注射器,穿刺心臟采血。將血液緩慢加注在盛有淋巴細胞分離液的離心管液面上,3500 r/min離心10min,吸取其白細胞層,用RPMI-1640培養基離心清洗3次后,調整至1.0×106 cells/mL的濃度,作為淋巴細胞液備用。在96孔微量組織培養板的孔中添加0.09mL淋巴細胞液和0.01mL PHA液,對照組則添加0.01mL RPMI-1640培養液。在5%CO2培養箱中28℃培養66h后,于每孔中分別添加0.01mL MTT液,再培養4h,終止培養,小心吸去培養液,加入二甲基亞楓0.10mL,溶解由細胞代謝MTT而產生的藍色沉淀,在722型分光光度計上(吸收波長為570 nm)測吸光值(OD570),以刺激指數(Stimulation index,SI)表示淋巴細胞轉化率。
刺激指數(SI)=試驗孔OD均值/對照孔OD均值
1.8 腸上皮內淋巴細胞的觀察與計數。
樣品經固定后,用各級乙醇脫水,經二甲苯透明后,用石蠟包埋,切片(厚度約5um),蘇木精和伊紅染色(HE染色法),中性樹膠封片,置顯微鏡下觀察其腸上皮內淋巴細胞(iIEL)。分別在前腸、中腸和后腸的每張切片的3個不同區域內觀察和計數腸上皮細胞和上皮內淋巴細胞(iIEL),計算100個腸上皮細胞段內iIEL的相對數量。
1.9 數據處理
試驗數據用STATISTIC6.0軟件進行統計分析,組間差異采用Duncan’s多重比較,顯著水平為0.05。
2 結果與分析
2.1 投喂BHI344菌株對斑點叉尾鮰白細胞吞噬活性的影響
投喂BHI344菌株對斑點叉尾鮰白細胞吞噬活性的影響結果見表1。
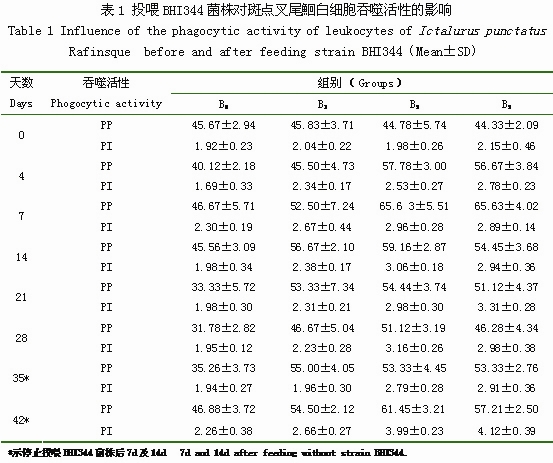
投喂BHI344菌株前,B1組、B3組、B5組與B0組的吞噬百分比(PP)和吞噬指數(PI)均無顯著性差異。投喂BHI344菌株后第4d,斑點叉尾鮰白細胞吞噬活性有些許增強,B1組、B3組、B5組的PP和PI均高于B0組。隨著投喂時間的延長,B1組、B3組、B5組的PP和PI還有一定的上升。B1組、B3組和B5組PP分別在第14d、7d、7d達到最高值,為56.67%、65.63%、65.63%;B0組PP則為31.33%-46.88%。在停止投喂BHI344菌株后,B1組、B3組和B5組PP雖有不同程度的下降,但在第35d和42d時仍明顯高于B0組。PI的變化趨勢與PP不同。投喂BHI344菌株后,B3組、B5 組PI開始上升,分別在第14d、21d達到較高值,為3.06和3.31,并在停止投喂BHI344菌株后的第14d呈現第2次較高值,分別為3.99和4.12,高于B0組;B0組PI則為1.92-2.30。而B1組PI在試驗期間與B0組基本無差異。
2.2 投喂BHI344菌株對斑點叉尾鮰血清溶菌酶活性的影響
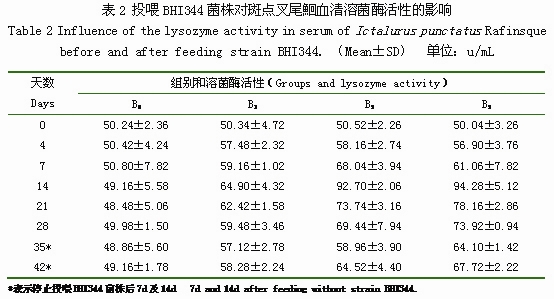
投喂BHI344菌株對斑點叉尾鮰血清溶菌酶活性的影響結果見表2。投喂BHI344菌株前, B1組、B3組、B5組與B0組的血清溶菌酶活性并無顯著差異。投喂BHI344菌株后第4d,B1組、B3組、B5組的溶菌酶活性稍微高于B0組。B1組、B3組、B5組變化趨勢基本相同,均于第14d達到最大值,分別為64.90u/mL、92.70u/mL、94.28u/mL。停止投喂BHI344菌株后,B1組、B3組、B5組仍顯著高于B0組。B3組和B5組在試驗期間基本無差異;而B3組、B5組的溶菌酶活性均高于B1組。
2.3 投喂BHI344菌株對斑點叉尾鮰血液淋巴細胞轉化率的影響
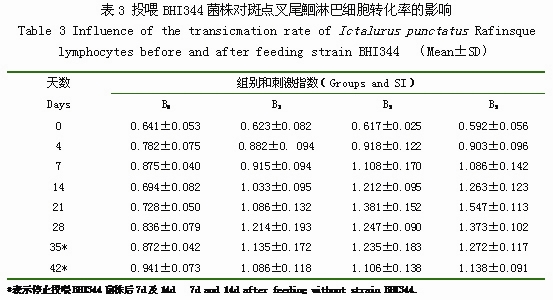
投喂BHI344菌株對斑點叉尾鮰淋巴細胞轉化率(SI)的影響結果詳見表3。投喂BHI344菌株前,B1組、B3組、B5組與B0組的淋巴細胞轉化率(SI)并無顯著性差異。投喂BHI344菌株后第14d,B1組、B3組、B5組開始與B0組呈現些許差異,分別于第28d、21d、21d達到最高值,分別為1.214、1.381、1.547。B0組SI則為0.641-0.941。停止投喂BHI344菌株后第7d,B1組與B0組無顯著性差異;停止投喂后第14d,B1組、B3組、B5組與B0組間并不呈現顯著差異。
2.4 投喂BHI344菌株對斑點叉尾鮰腸上皮內淋巴細胞的影響
HE染色結果表明:上皮內淋巴細胞為分散在分布于腸絨毛上的一群特殊淋巴細胞,一般位于上皮內細胞間隙、上皮細胞內以及基膜處,多數位于上皮細胞基底部,在各組魚的前中后腸絨毛上均有分布,細胞較小,胞核大而圓,深染。不同的腸段,其iIEL數量也有所不同,后腸最多,前腸和中腸次之。
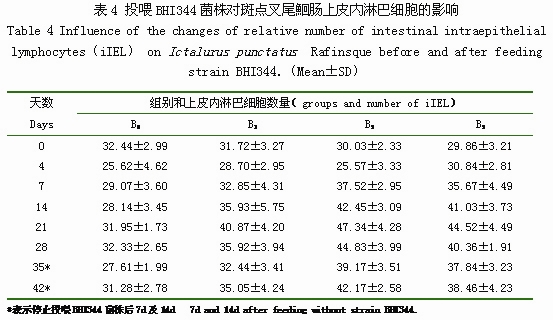
投喂BHI344菌株對斑點叉尾鮰iIEL相對數量的影響見表4。從表4可以看出,投喂BHI344菌株前,B0組、B1組、B3組、B5組間均無顯著差異。投喂BHI344菌株后第7d,B3組iIEL相對數量(37.52%)開始顯著高于B0組(29.07%);投喂后第14d,B5組iIEL相對數量(41.03%)開始顯著高于B0組(28.14%)。B1組、B3組、B5組均在第21d達到最高值,分別為40.87%、47.34%、44.52%;B0組iIEL相對數量則為25.62%-32.44%。B1組除第21d外,基本與B0組無顯著差異;停止投喂BHI344菌株后第14d時,B3組和B5組iIEL數仍顯著高于B0組。
3 討論
3.1 BHI344菌株對斑點叉尾鮰免疫機能的影響
吞噬細胞擔負吞噬膠質顆粒、衰老及死亡細胞和病原微生物等抗原物質的作用,是魚類有機體抵抗疾病的一種方式。魚類吞噬細胞的吞噬活性不僅受溫度的影響(孟躍華等,1990;李靜和陳昌福,1999),而且還受到餌料、免疫激活劑等的影響(吳志新等,1998)。溶菌酶是存在于許多魚類的體表黏液、腸道黏液、血清和巨噬細胞中的一種水解酶。血清溶菌酶主要來自血液中,它能水解革蘭氏陽性菌的細胞壁中粘肽的乙酰氨基多糖并使之裂解被釋放出來,形成一個水解體系,破壞和消除侵入體內的異物,從而擔負起機體防御的機能。魚類溶菌酶的水平受魚的種類、特定組織、餌料、pH值、溫度甚至生殖周期等許多因素的影響(陳昌福和紀國良,1990)。一般認為,對白細胞吞噬活性和溶菌酶活性的測定可反映魚體的免疫機能。
在陸生動物中所進行的一系列實驗表明,動物體內的益生菌群的存在可以增強動物自身的免疫力,其免疫指標如巨噬細胞、免疫球蛋白、抗體等都與益生菌群有著密切的相關性。近年來也有文獻報道水產動物益生菌與其免疫力的關系(桂遠明等,1994;孫艦軍和丁美麗,1999)。桂遠明等(1994)從正常鯉魚腸道中分離出Jy10(節桿菌)和Jy13(乳桿菌)制成益生菌制劑投喂鰱,發現鰱白細胞吞噬率與吞噬指數、巨噬細胞吞噬率與E玫瑰花環形成率均高于對照組,且受病菌攻擊后,試驗組的成活率和特異性抗體效價均明顯高于對照組。孫艦軍和丁美麗(1999)把光合細菌拌入餌料投喂中國對蝦,22天后發現蝦體酚氧化酶(PO)、超氧化物歧化酶(SOD)、溶菌和抗菌活力分別比對照組高102.2%、22.1%、53.4%和14.0%,血細胞數目高出67.2%。王宏田和張培軍(2000)發現用含有大馬哈魚生長激素基因的重組酵母菌可以增加牙鲆血清蛋白的含量,增加牙鲆血清中溶菌酶和抗蛋白物質的活性。本試驗發現濃度為1.0×1011cfu/kg飼料、3.0×1011cfu/kg飼料、5.0×1011cfu/kg飼料的BHI344菌株均能些許提高斑點叉尾鮰白細胞吞噬活性和血清溶菌酶活性。
趙明É(2002)認為,使用微生態活菌制劑后,4d-5d開始發揮作用,7d-10d效果最好。王雄等(2004)在微生態制劑對銀鯽血清溶菌酶活性研究中發現,投喂微生態制劑后第4d,試驗組即與對照組呈現顯著性差異,第14d達到峰值。本研究結果與之基本相符,B1組、B3組、B5組的白細胞吞噬活性和溶菌酶活性均從第4d起即高于B0組,并于7d-14d達到最高值。說明BHI344菌株能迅速且明顯增強斑點叉尾鮰的白細胞吞噬活性和溶菌酶活性。而本試驗中,BHI344菌株對斑點叉尾鮰淋巴細胞轉化率的提高作用相對則緩慢些,B1組、B3組、B5組在投喂BHI344菌株14d才開始顯著高于B0組,B0組、B1組、B3組、B5組均于第28d達到最高值。
具有適應性免疫系統(adaptive immune system)的動物一個主要特征是其免疫系統中存在淋巴細胞和免疫球蛋白,魚類是具有這種免疫系統最原始的動物(Estepa and Coll,1992)。離體培養淋巴細胞受到特異性和非特異性有絲分裂原的刺激后,可轉化為淋巴母細胞,由于這種轉化是與機體的免疫機能有關,因此,淋巴細胞轉化率常被用作評價機體細胞免疫功能的指標(王世若等,1996)。目前,對淋巴細胞轉化率的測定在人類和畜禽內研究的較多,在水產動物中則少見報道。陳昌福(1998)、李亞南(2000)、曾慷等(2001)、丁光等(2003)、烏日琴等(2003)曾通過3H-TdR摻入法、形態學檢查法、MTT顏色反應法分別對關于PHA、SPA、ISKNV、ConA、LPS對斑點叉尾鮰、鱖、鯉、牙鲆的外周血及免疫器官中的淋巴細胞轉化的影響進行了研究,說明淋巴細胞轉化的高低與試驗對象、取樣組織或器官、刺激物種類、溫度以及試驗對象是否應激有關。在本試驗所采用的BHI344菌株濃度范圍中,發現隨著BHI344菌株的濃度逐漸增大,斑點叉尾鮰血液淋巴細胞轉化率也隨之上升。但停止投喂后14d,B1組、B3組、B5組SI與B0組之間無顯著差異。這是否與所用BHI344菌株濃度或者魚的種類有關,尚需進一步研究。
腸道黏膜不僅是消化吸收營養物質的場所,而且還可識別入侵的有害微生物以及被腸黏膜上皮吸收的異己物質并加以排除,因此,腸道黏膜免疫是機體防止感染的第一道防線。黏膜免疫系統中有3類性質獨特的免疫細胞:M細胞、上皮內淋巴細胞(iIEL)、腸黏膜上皮細胞,其中iIEL位于腸上皮細胞間,由于它的特殊定位,使它成為第一個與黏膜表面抗原接觸的免疫細胞,它的抗原識別途徑和激活特點及其相關分子,iIEL在黏膜免疫耐受與黏膜免疫應答激活及黏膜免疫防御中的作用是黏膜免疫領域當今研究的熱點。有研究表明腸上皮內淋巴細胞可隨動物的種屬、年齡及食物等多種因素的變化而有所不同(Fujifashi et al.,1994),還可能參加黏膜免疫應答(謝遵江等,1997)。Asai K等(2000)報道,在上皮中,15%的細胞為淋巴細胞,是黏膜免疫系統中最先接觸抗原的免疫活性細胞。它不但參與免疫反應,而且通過偽足與上皮細胞接觸,加速上皮細胞再生,所以在腸道黏膜中起重要的免疫屏障作用。本試驗中,濃度為3.0×1011cfu/kg、5.0×1011cfu/kg飼料的BHI344菌株能提高斑點叉尾鮰iIEL的相對數量,有利于增強腸道的免疫屏障和機械屏障功能。
3.2 BHI344菌株的營養與免疫
營養與免疫的關系研究已成為動物營養研究中的一個重點,因為動物的免疫狀態對動物的生長有很大影響,而機體的免疫狀態又受多種營養因素影響,動物消化吸收的蛋白質、能量、礦物質元素、維生素等都對免疫功能有很大影響。而微生態制劑的添加可能也會影響以上各種營養成分的消化和吸收,最終影響機體免疫狀況。
已有不少研究表明BHI344菌株能夠分泌大量胞外酶,參與飼料的降解、消化,提高飼料利用率(Kazuaki et al.,1999),并且芽孢桿菌代謝產生的酶對宿主生產性能或生理生化指標產生明顯影響(Kerovuo et al.,1998),且在生長繁殖過程中能夠產生乙酸等揮發性脂肪酸,降低腸道pH值;產生B族維生素和維生素C,為動物提供維生素營養(張民和刁其玉,2003)。芽孢桿菌還能促進腸道相關淋巴組織處于高度反應的“準備狀態”,同時使免疫器官發育加快,免疫系統成熟快而早,T、B淋巴細胞數量增多,動物體液和細胞免疫水平提高(Inooka et al.,1986)。研究顯示,微生態制劑中許多有益細菌的細胞壁具有免疫活性,如:乳酸桿菌的肽聚糖(孟凡倫等,1998)、雙岐桿菌的細胞壁粘肽、芽孢桿菌的細胞壁成分(Sekine,1985)等,這類物質都具有刺激機體免疫系統,非特異性地提高動物免疫功能的作用。而關于芽孢桿菌的有效成分如脂磷壁酸和肽聚糖、細胞糖蛋白等物質與魚類免疫功能間的關系以及這些物質具體生物活性的定性和定量研究,活性物質使用的途徑及使用時間等方面的研究尚需進一步探討。
4 小結
4.1 濃度為1.0×1011 cfu/kg飼料、3.0×1011 cfu/kg飼料、5.0×1011cfu/kg飼料的BHI344菌株均能些許提高斑點叉尾鮰白細胞吞噬活性和溶菌酶活性,上調斑點叉尾鮰非特異性免疫機能,其中以B3組和B5組效果更明顯;
4.2 投喂BHI344菌株后14d-35d時,B1組、B3組、B5組的SI有所升高,但停止投喂BHI344菌株14d時,B0組、B1組、B3組、B5組的SI并無顯著性差異;
4.3 當BHI344菌株在飼料中添加濃度為3.0×1011 cfu/kg飼料和5.0×1011cfu/kg飼料時,斑點叉尾鮰iIEL的相對數量些許增加,斑點叉尾鮰腸道的免疫屏障和機械屏障功能得以增強。
綜上所述,BHI344菌株能些許增強斑點叉尾鮰的白細胞吞噬活性、溶菌酶活性及iIEL的相對數量,增強斑點叉尾鮰的免疫機能。其中,當BHI344菌株濃度為3.0×1011 cfu/kg飼料,投喂時間為14d時,斑點叉尾鮰免疫機能活性上升較大。
| 發表評論 |
咨詢:0779-2029779
隨時,隨地,伴你身邊!
圖文推薦
最新漁藥新聞
今日要聞
熱點推薦
X
