1 范圍
本標準規定了無公害水產品中漁藥及通過環境污染造成的藥物殘留的最高限量。
本標準適用于水產養殖品及初級加工水產品、冷凍水產品,其他水產加工品可以參照使用。
2 規范性引用文件
下列文件中的條款通過本標準的引用而成為本標準的條款。凡是注日期的引用文件,其隨后所有的修改單(不包括勘誤的內容)或修訂版均不適用于本標準,然而,鼓勵根據本標準達成協議的各方研究是否可使用這些文件的最新版本。凡是不注日期的引用文件,其最新版本適用于本標準。
NY 5071 無公害食品 漁用藥物使用準則
SC/T 3303—1997 凍烤鰻
SN/T 0197—1993 出口肉中喹乙醇殘留量檢驗方法
SN 0206—1993 出口活鰻魚中噁喹酸殘留量檢驗方法
SN 0208—1993 出口肉中十種磺胺殘留量檢驗方法
SN 0530—1996 出口肉品中呋喃唑酮殘留量的檢驗方法 液相色譜法
3 術語和定義
下列術語和定義適用于本標準。
3.1
漁用藥物 fishery drugs
用以預防、控制和治療水產動、植物的病、蟲、害,促進養殖品種健康生長,增強機體抗病能力以及改善養殖水體質量的一切物質,簡稱“漁藥”。
3.2
漁藥殘留 residues of fishery drugs
在水產品的任何食用部分中漁藥的原型化合物或/和其代謝產物,并包括與藥物本體有關雜質的殘留。
3.3
最高殘留限量 maximum residue Limit,MRL
允許存在于水產品表面或內部(主要指肉與皮或/和性腺)的該藥(或標志殘留物)的最高量/濃度(以鮮重計,表示為:mg/kg或mg/kg)。
4 要求
4.1 漁藥使用
水產養殖中禁止使用國家、行業頒布的禁用藥物,漁藥使用時按NY 5071的要求進行。
4.2 水產品中漁藥殘留限量要求
水產品中漁藥殘留限量要求見表1。
表1 水產品中漁藥殘留限量 藥物類別 藥物名稱 指標(MPL)/(mg/kg) 中文 英文 抗生素類 四環素類 金霉素 chlortetracycline 100 土霉素 Oxytetracycline 100 四環素 Tetracycline 100 氯霉素類 氯霉素 Chloramphenicol 不得檢出 磺胺類及增效劑 磺胺嘧啶 Sulfadiazine 磺胺甲基嘧啶 Sulfamerazine 磺胺二甲基嘧啶 Sulfadimidine 磺胺甲噁唑 sulfamethoxazole 100(以總量計) 甲氧芐啶 Trimethoprim 50 喹諾酮類 噁喹酸 Oxilinic acid 300 硝基呋喃類 呋喃唑酮 Furazolidone 不得檢出 其他 己烯雌酚 Diethylstilbestrol 不得檢出 喹乙醇 Olaquindox 不得檢出
5 檢測方法
5.1 金霉素、土霉素、四環霉
金霉素測定按NY 5029—2001中附錄B規定執行,土霉素、四環素按SC/T 3303—1997中附錄A規定執行。
5.2 氯霉素
氯霉素殘留量的篩選測定方法按本標準中附錄A執行,測定按NY 5029—2001中附錄D(氣相色譜法)的規定執行。
5.3 磺胺類
磺胺類中的磺胺甲基嘧啶、磺胺二甲基嘧啶的測定按SC/T 3303的規定執行,其他磺胺類按SN/T 0208的規定執行。
5.4 噁喹酸
噁喹酸的測定按SN/T 0206的規定執行。
5.5 呋喃唑酮
呋喃唑酮的測定按SN/T 0530的規定執行。
5.6 己烯雌酚
己烯雌酚殘留量的篩選測定方法按本標準中附錄B規定執行。
5.7 喹乙醇
喹乙醇的測定按SN/T 0197的規定執行。
6 檢驗規則
6.1 檢驗項目
按相應產品標準的規定項目進行。
6.2 抽樣
6.2.1 組批規則
同一水產養殖場內,在品種、養殖時間、養殖方式基本相同的養殖水產品為一批(同一養殖池,或多個養殖池);水產加工品按批號抽樣,在原料及生產條件基本相同下同一天或同一班組生產的產品為一批。
6.2.2 抽樣方法
6.2.2.1 養殖水產品
隨機從各養殖池抽取有代表性的樣品,取樣量見表2。
表2 取樣量
|
生物數量/(尾、只) |
取樣量/(尾、只) |
|
500以內 |
2 |
|
500~1 000 |
4 |
|
1 001~5 000 |
10 |
|
5 001~10 000 |
20 |
|
≥10 001 |
30 |
 ……(A.1)
……(A.1)
式中:
E——吸光度值,%;
A——標準或樣品的吸光度值;
A0——0標準的吸光度值。
以計算的標準值繪成一個對應氯霉素濃度(ng/L)的半對數坐標系統曲線圖,校正的曲線在50 ng/L~1 350 ng/L的范圍內應成為線性,相對應的每一個樣品的濃度,可以從曲線上讀出。乘出稀釋倍數即可得到樣品中氯霉素的實際濃度(ng/kg)。
附 錄 B
(規范性附錄)
己烯雌酚(DES)殘留的酶聯免疫測定法
B.1 適用范圍
本方法適用于測定水產品肌肉等可食組織中己烯雌酚的殘留量。
B.2 原理
測定的基礎是利用抗體抗原反應。微孔板包被有針對兔IgG(DES抗體)的羊抗體,加入DES抗、標準和樣品溶液。DES與DES抗體連接,同時DES抗體與羊抗體連接。洗滌步驟后,加入DES酶標記物,DES酶標記物與孔中未結合的DES抗體結合,然后在洗滌步驟中除去未結合的DES酶標記物。將酶基質和發色劑(四甲基聯苯胺)加入到孔中并孵育;結合的酶標記物將無色的發色劑轉化為藍色的產物。加入反應停止液后使顏色由藍變為黃,在450 nm處沒量,吸光度與樣品的己烯雌酚濃度成反比。
B.3 檢測限
己烯雌酚檢測的下限為1mg/kg。
B.4 儀器
B.4.1 微孔酶標儀(450 nm)。
B.4.2 離心機。
B.4.3 37℃恒溫箱。
B.4.4 移液器。
B.4.5 50mL,100mL,450mL微量加液器。
B.4.6 RIDA C18柱等。
B.5 試劑和標準溶液
除非另有說明,在分析中僅使用確認為分析純的試劑和蒸餾水或去離子水或相當純度的水。
B.5.1 叔丁基甲基醚。
B.5.2 石油醚。
B.5.3 二氯甲烷。
B.5.4 6 mol/L磷酸。
B.5.5 乙酸鈉緩沖液等。
B.5.6 提供的DES標準液為直接使用液,濃度為0、12.5×10–9mol/L、25×10–9mol/L、50×10–9mol/L、100×10–9mol/L、200×10–9mol/L。
B.6 樣品處理
B.6.1 取5.0 g肌肉(除去脂肪組織),用10 mL pH為7.2的67 m mol/L磷酸緩沖液研磨后,用8 mL叔丁基甲基醚提取研磨物,強烈振蕩20 min;離心10 min(4 000 r/min);移去上清液,用8 mL叔丁基甲基醚重復提取沉淀物。
B.6.2 將兩次提取的醚相合并,并且蒸發;用1 mL甲醇(70%)溶解干燥的殘留物;用3 mL石油醚洗滌甲醇溶液(研磨15 s,短時間離心,吸除石油醚)。
B.6.3 蒸發甲醇溶液,用1 mL二氯甲烷溶解后,再用3 mL 1 mol/L的氫氧化鈉(NaOH)溶液提取;然后300 mL 6 mol/L磷酸中和提取液,用RIDA C18柱進行純化。
B.7 測定程序(室溫20℃~24℃條件下操作)
B.7.1 將足夠標準和樣品所用數量的孔條插入微孔架,標準和樣品做兩個平行實驗,記錄下標準和樣品的位置。
B.7.2 加入20mL的標準和處理好的樣品到各自的微孔中,標準和樣品做兩個平行實驗。
B.7.3 加入50mL稀釋后的DES抗體到每一個微孔中,充分混合并在2℃~8℃孵育過夜(注意:在第二早上繼續進行實驗之前,微孔板應在室溫下放置30 min以上,稀釋用緩沖液也應回到室溫,因此最好將緩沖液放在室溫下過夜)。
B.7.4 倒出孔中的液體,將微孔架倒置在吸水紙上拍打(每行拍打3次)以保證完全除去孔中的液體,用250mL蒸餾水充入孔中,再次倒掉微孔中液體,再重復操作兩次。
B.7.5 加入5mL稀釋的酶標記物到微孔底部,室溫孵育1 h。
B.7.6 倒出孔中的液體,將微孔架倒置在吸水紙上拍打(每次拍打3次)以保證完全除去孔中的液體,用250mL蒸餾水充入孔中,再次倒掉微孔中液體,再重復操作一次。
B.7.7 加入50mL基質和50mL發色試劑到微孔中,充分混合并在室溫暗處孵育15 min。
B.7.8 加入100mL反應停止液到微孔中,混合好在450 nm處測量吸光度值(可選擇>600nm的參比濾光片),以空氣為空白,必須在加入停止液后60 min內讀取吸光度值。
B.8 結果
所獲得的標準和樣品吸光度值的平均值除以第一個標準(0標準)的吸光度值再乘以100,得到以百分比給出的吸光度值,以式(B.1)表示: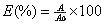 ……(B.1)
……(B.1)
式中:
E——吸光度值,%;
A——標準或樣品的吸光度值;
A0——0標準的吸光度值。
以計算的標準值繪成一個對應DES濃度(ng/L)的半對數坐標系統曲線圖,校正的曲線在25 ng/L~200 ng/L的范圍內應成為線性,相對應的每一個樣品的濃度,可以從曲線上讀出。乘以稀釋倍數即可得到樣品中DES的實際濃度(ng/kg)。
| 發表評論 |
咨詢:0779-2029779
隨時,隨地,伴你身邊!
圖文推薦
最新漁藥新聞
今日要聞
熱點推薦
X
